Neogobius melanostomus (Pallas 1811)
- obcy gatunek ryby w naszym morzu
Rodzina babkowatych (Gobidae) jest jedną z najliczniej reprezentowanych rodzin, obejmującą ponad 1800 gatunków. Przedstawiciele tej rodziny osiągają niewielkie rozmiary, ich długość rzadko przekracza kilkanaście centymetrów. W polskiej części Morza Bałtyckiego odnotowano pięć gatunków tej rodziny (Rebiszewski, Rolik 1975, Załachowski 1997). Pierwszy okaz Neogobius melanostomus - nowy dla ichtiofauny Bałtyku gatunek z rodziny Gobidae - zanotowano w rejonie portu Hel w czerwcu 1990 roku.

Na podstawie wstecznie oznaczonego z łuski wieku ryby, można przypuszczać, że zasiedlenie tym gatunkiem rozpoczęło się przed rokiem 1987. Miejscem rozprzestrzenienia Neogobius melanostomus był przypuszczalnie port w Gdyni (Skóra i Stolarski 1993).
Do wód Bałtyku N. melanostomus prawdopodobnie został zawleczony z rejonu Mórz: Czarnego, Kaspijskiego lub Azowskiego, w wodach balastowych statków. W Bałtyku gatunek ten znalazł sprzyjające warunki środowiskowe i w ciągu kilku lat rozprzestrzenił się na całą Zatokę Gdańską (Skóra i Stolarski 1995).Od chwili zaobserwowania N. melanostomus w Zatoce Gdańskiej gatunek ten stał się obiektem badań (Skóra i Stolarski 1993;Skóra i Stolarski 1995; Skóra 1996a;Skóra 1996b;Kuczyński 1995;Bzoma 1998, Skóra i Rzeźnik 2000, Sapota 2002).
Początek rozprzestrzeniania N. melanostomus w Europie zauważono w latach 80, gdy stwierdzono, że bytuje on w rzece Moskwa (Sokolov i in. 1989). Był to, jak się przypuszcza, przejściowy etap jego przenoszenia ku Bałtykowi. Razem z wodami balastowymi statków kursujących z rejonu Mórz Czarnego i Kaspijskiego dotarł do Zatoki Gdańskiej (Skóra, Stolarski 1993a).

Pierwszy
bałtycki okaz tego gatunku złowiono w 1990 roku w rejonie portu
Hel.
Na podstawie wieku ryby i
rozmieszczenia raportów o miejscu złowienia kolejnych ustalono, iż
dotarcie tego gatunku do Zatoki Gdańskiej musiało nastąpić przynajmniej
3 - 4 lata wcześniej w rejonie Gdyni (Skóra, Stolarski 1993b). W roku 1994
obecność tych ryb odnotowywano już niemal w całej polskiej części
Zatoki Gdańskiej a rok później, pozyskano pierwsze okazy spoza tego
akwenu (Grygiel 1995, Kuczyński 1995). Pod sam koniec lat 90 Neogobius
melanostomus dotarł (pewnie przez ujścia rzek) do jezior Łebsko i
Gardno w Słowińskim Parku Narodowym (Ciepielewski
i Hornatkiewicz-Żbik, 2003). Obserwując stały wzrost liczebny populacji N.
melanostomus w Zatoce Gdańskiej (Sapota 2002) zauważono, że
zaczął wnikać w estuarium Wisły. W końcu lat 90 występował już
zarówno w Motławie jak i Wiśle Śmiałej w rejonie Przegaliny
(Skóra, Kozik un.pub). W roku 1999 stwierdzono pierwsze okazy w
polskiej części Zalewu Wiślanego (Borowski 1999), a dwa lata później w
jego części rosyjskiej (Tylik 2001). Jak wynika z najnowszych doniesień
ekspansja N. melanostomus posuwa się w górę rzeki oraz jej dopływów.
Najwyżej położone stanowisko zostało znalezione 130 km od ujścia rzeki
na wysokości Świecia (Kostrzewa, Grabowski 2003). Tu zasięg
zoogeograficznego występowania N. melanostomus zaczyna się wtórnie
nakładać z podążającym od południowego wschodu Europy, innym ponto -
kaspijskim gatunkiem - Neogobius fluviatilis, który dotarł już do
odcinka pomiędzy Gniewem a Tczewem (Kol. 9.07.2003. Skóra K.E., dane n.publ). Do niedawna całkowicie
brakowało potwierdzeń występowania Neogobius melanostomus na środkowym
i zachodnim wybrzeżu Polski a
jedyna informacja z rejonu Zatoki Pomorskiej z 1996 roku nie była dobrze
udokumentowana.
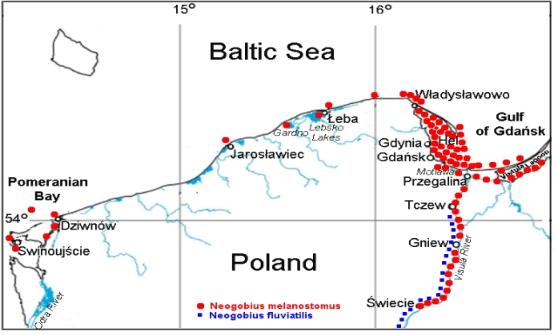
Rys. 1. Lokalizacje obecności N. melanostomus w Polsce (do roku 2005)
Wykonany w 2003 roku zwiad dostarczył uzupełniających danych. Obserwacje podwodne oraz wywiady z wędkarzami pozwoliły na zebranie materiału z miejsc nowych. Stwierdzono, że Neogobius melanostomus występuje w rejonie umocnień brzegowych k/Jarosławca oraz w Dziwnowie w kanale ujściowym rzeki (foto. 1, 2; Skóra, Woźniewska dane nie publikowane). Otrzymano także pierwsze informacje o połowach tego gatunku przez wędkarzy w Kanale Piastowskim w Świnoujściu (Wolnomiejski N., Stepanowska K., informacja ustna).
Potwierdzono, spodziewaną na podstawie doniesień Ciepielewskiego i Hornatkiewicz - Żbik 2003) obecność N. melanostomus w Łebie - w basenach portu i ujściowym łączącym morze z jeziorem Łebsko odcinku rzeki (Foto. 3,4; Skóra, Woźniewska dane nie publikowane).

Stwierdzono także, że miejscem bardzo licznego zasiedlenia jest obecnie rejon podwodnych umocnień portu Władysławowo (Foto. 5; Skóra, Woźniewska dane nie publikowane).

Pojedyncze okazy jakie u niemieckich wybrzeży w 1999 roku stwierdził w połowach rybackich (H. Winkler, dane nie publikowane) zostały ostatnio wzbogacone o obserwację pochodzącą z rejonu przylądka Darss na wyspie Zingst (Skóra 2003). Jest to jak na razie najdalszy zachodni kraniec zakresu występowania tego gatunku w Bałtyku. Na wschodnim wybrzeżu tego morza, N. melanostomus został odnotowany rok wcześniej, gdy pojedynczy okaz złowiono w estońskiej Zatoce Parnu (Ojaver 2002).
Jak dotąd brak jest obserwacji na temat występowania N. melanostomus u północnych brzegów Bałtyku. Można się jednak spodziewać, że charakter i rodzaj skandynawskich siedlisk w sposób optymalny będą odpowiadać sposobowi życia tego gatunku co doprowadzi do szybkiej eskalacji jego inwazji w tym morzu. Warto dodać, że N. melanostomus wykazuje także ekspansje w górę rzek zlewiska Morza Czarnego. Jak podaje Simonovic i in (2001) w latach 1997 i 98 dwie ryby tego gatunku odkryto w granicach Jugosławii k / Prahovo (a), 861 km od ujścia Dunaju. Dwa lata później stwierdzono go już w rejonie Wiednia (Wiesner, 2000). Wydaje się tylko kwestią czasu aby gatunek ten powtórzył drogę rozprzestrzeniania się N. fluviatilis oraz N. gymnotrachelus, które przez Dniepr, Prypeć i Kanał Królewski przeniknęły do dorzecza Wisły (Danilkiewicz 1996 i 1998). O jego współczesnych antropogenicznych możliwościach przenikania w górę rzeki może świadczyć fakt dotarcia aż w rejon Zlobin (a) na Białorusi (Guljugin 1998). Także droga wodna Kanałem Dunaj - Men wydaje się brama na jego szybkie przeniknięcie do Morza Północnego.
Można przypuszczać, że sukces w globalnej ekspansji gatunku, a Neogobius melanostomus dotarł przecież aż do Wielkich Jezior Ameryki Północnej (Jude, i in. 1991), jest w dużej mierze bezpośrednio spowodowany czynnikami antropogenicznymi – rozwojem żeglugi i hydrotechnicznymi przekształceniami rzek i wybrzeży. Nie można jednak wykluczać, że w rejonach naturalnego bytowania gatunku oraz sąsiednich, a także w miejscach do których został zawleczony zachodzą sprzyjające mu ekologiczne zmiany. Tylko częściowo mogą one być tłumaczone efektem naturalnej ewolucji biotopów i biocenoz. Głównymi akceleratorami tych procesów pozostają dziś czynniki antropogeniczne – oddziaływujące pośrednio na klimat, eutrofizację akwenów, czy ubytki w zasobach gatunków będących w stosunku do N. melanostomus naturalnymi drapieżnikami.
W zaistniałych warunkach naturalne biologiczne i ekologiczne predyspozycje gatunku będą sprzyjać jego dalszemu rozprzestrzenieniu się.
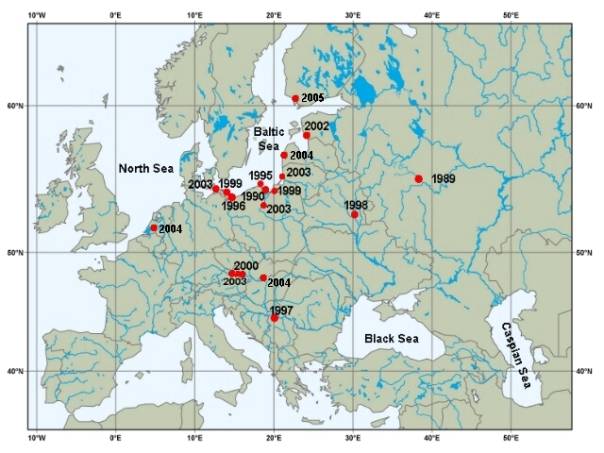
Rys. 2. Kalendarium rozprzestrzeniania się N. melanostomus w Europie
(poza naturalnym zasięgiem jego występowania).
. -
miejsca raportów o obecności N. melanostomus
Charakterystyka
Rys. 4. Neogobius
melanostomus (oryginał).
Na rysunku zaznaczono charakterystyczną czarną
plamę
na pierwszej płetwie grzbietowej, pominięto natomiast silnie
osobniczo
zróżnicowany wzór plam na bokach ciała tych ryb.
Stanowisko systematyczne
Rząd |
Perciformens |
okoniokształtne |
Rodzina |
Gobiidae |
babkowate |
Rodzaj |
Neogobius |
|
Gatunek |
Neogobius melanostomus (Pallas 1811) |
babka bycza |
Rodzaj Neogobius był pierwotnie podrodzajem w rodzaju Gobius (Ilin 1927), ale został podniesiony do rodzaju przez Berga (1949). Nowy rodzaj Neogobius zawierał gatunki w podrodzajach: Apollonia, Pontinola, Chasar i Eichwaldia (Pinchuk 1992). Następnie do tego rodzaju dołączono podrodzaj Babka. Poprzednia nazwa babki byczej to Gobius melanostomus i Gobius (Apollonia) melanostomus (Berg 1949). N. melanostomus affinis z Morza Kaspijskiego jest wyodrębniony jako osobny podgatunek (Berg 1949).
Różne źródła (Charlebois 1997) podają następujące gatunki wchodzące w skład rodzaju Neogobius:
-
N. (Chasar) bathybius,
-
N. (Eichwaldia) caspius,
-
N. cephalarges,
-
N. cephalargoides,
-
N. fluviatilis (Pallas),
-
N. (Babka) gymnotrachelus (Kessler),
-
N. kessleri (Gunther),
-
N. ophiocephalus,
-
N. playtrostris (Pallas),
-
N. ratan,
-
N. syrman.
W literaturze spotyka się kilka nazw gatunkowych babki byczej. Są to: Gobius melanostomus i Gobius (Apollonia) melanous (Berg 1949), dla podgatunku kaspijskiego N. melanostomus affinis (Berg 1949). Stosowanych jest również wiele nazw potocznych. W języku angielskim funkcjonują nazwy: round goby, caspian goby, kruglyak goby, azov goby, black spotted goby; w języku rosyjskim: bobyr (w rejonie Dniepru); kruglyak, černyj byčok, kval, cygan (w okolicach Odessy), piesočnik, piesčanik (w rejonie Krymu); buc, kubar, chłjak, žarkowskij byčok, cobačka, kašnik, kucak, černorotyj byčok (w strefie Morza Azowskiego; w języku rumuńskim: guvid-stronghil, guvid, negrar, strongil, babca negra; w języku bułgarskim: bychok koval, kuznets, chernyj bychok, trevno popche, a także w języku niemieckim Schwarzmundgrundel i Kruglyak-grundel i w języku francuskim gobie à taches (Berg 1949; Miller 1986). W języku polskim proponowane są następujące nazwy nazwy: babka bycza, babka obła, babka okrągła (Skóra i Stolarski 1996) oraz babka pancerna (Kuczyński 1995). W języku potocznym stosuje się nazwy byczek i byczun.
Anatomia i morfologia
Kolor ciała ryby jest szarobrązowy z ciemnymi bocznymi plamami. Dorosłe samce w okresie tarła są zupełnie czarne, z żółtymi plamami na płetwach nieparzystych. Na skraju wszystkie płetwy są żółte. Charakterystyczna dla tego gatunku czarna plama występuje na D1 między IV a VI promieniem. Młode mają jasny brzeg plamy. Płetwy brzuszne są zrośnięte i tworzą charakterystyczną przyssawkę (0,6-0,8 długości brzucha). Wysokość płetwy ogonowej wynosi około 2/3 jej długości. Ciało ryby jest pokryte łuską cykloidalną na bokach, grzbiecie, brzuchu i 1/4 pokryw skrzelowych.
Głowa jest równie szeroka albo szersza niż długa. Wysokość głowy równa się od 0,9 do 1,2 jej szerokości. Długość głowy wynosi 22-23% długości całkowitej. Miller (1986) podaje, że odległość między oczami wynosi od 4/5 do niemal równej średnicy oka. Natomiast według Berga (1948) ta odległość jest równa lub przekracza średnicę gałki ocznej. Kąt szczękowy znajduje się poniżej pierwszej ćwierci oka. Dolna szczęka nie jest wystająca. Pysk ma długość 1,1-1,4 razy średnicy oczodołu. Górna szczęka zwęża się nieco do tyłu. Występuje 6 (rzadko 7) pod-oczodołowych otworów linii bocznej. N. melanostomus posiada górne i dolne zęby gardłowe, przy czym tylne zęby są mniejsze niż przednie. Ze względu na demersalny tryb życia Neogobius melanostomus nie posiada pęcherza pławnego (Pinchuk 1992).
Otwory linii bocznej nie są zamknięte w system kanałów otwierających się na powierzchni, dlatego ryba nie ma widocznej linii bocznej. Obecność powierzchniowych zakończeń linii bocznej czyni ten gatunek bardziej wrażliwym na ruchy wody niż gatunki ryb o zakończeniach linii bocznej zamkniętej w systemie kanałów (Jude i inni 1995).
Obie płcie posiadają wyrostek genitalny pomiędzy odbytem a podstawą płetwy odbytowej. Żeński wyrostek - o długości 0,3-0,5 mm i szerokości 0,2-0,4 m jest szeroki i tępy. Męski jest dłuższy - 0,3-0,6 mm i jest ostro zakończony (Juszczyk 1975; Miller 1984).
Samce mają 2 pary gruczołów, które są połączone z jądrami. Jedna para to pęcherzyki nasienne (gruczoły przewodu nasiennego), usytuowane poniżej jąder. Wielkość tych gruczołów zwiększa się wraz z dojrzałością. Druga para to gruczoły cementowe, związane z tylnym końcem jąder. Przed tarłem gruczoły te są duże, dobrze unaczynione, lekko przejrzyste. Są one usytuowane zewnętrzno-bocznie w stosunku do jąder w górnej części jamy brzusznej. Gruczoły wydzielają koloidalny lepki płyn, którego funkcja nie jest jeszcze wyjaśniona (Miller 1984). Płyn ten może zwiększać przeżywalność plemników, zwiększać kontakt plemników z jajami albo być użyty przez samce do pokrycia gniazda przed złożeniem jaj (Juszczyk 1975; Miller 1984).
Cechy merystyczne
Pierwsza płetwa grzbietowa (D1) składa się z 5-7 (zwykle 6) promieni twardych.
Druga płetwa grzbietowa (D2) składa się z 1 promienia twardego i 13-16 promieni miękkich.
Płetwa odbytowa (A) składa się z 1 promienia twardego i 11-14 promieni miękkich.
Płetwa piersiowa (P) składa się z 17-20 promieni miękkich.
Wzór wygląda następująco (Pinchuk 1992):
D1 VI (V-VII);
D2 I + 14-16 (13-16);
A I + 11-13 (11-13);
P 18-19 (17-20).
Występowanie zoogeograficzne
Pierwotnie gatunek ten występował w przybrzeżnej strefie mórz: Czarnego, Azowskiego, Marmara i Kaspijskiego. Ponadto występował w niektórych rzekach należących do zlewni tych mórz. Należą do nich: Dunaj – od ujścia do Vidina, Vit – od ujścia do Pleviny, Kančija, Ropotam, Rezovskaja, Dniestr – od ujścia do Kamieńca Podolskiego, Južnyj Bug – od ujścia do górnego biegu, Dniepr wraz z dopływami – od ujścia do środkowego biegu, Don – od ujścia do Rostowa, Doniec, rzeki Półwyspu Krymskiego i Wybrzeża Kaukaskiego - Mezib,Pšada, Vulan, Kodor, Čoroch (Svetovidov 1964).
W Morzu Bałtyckim gatunek ten występuje nie później niż 1987 roku (Skóra i Stolarski 1993, Skóra 1996). Babka bycza przedostała się do wód Zatoki Gdańskiej prawdopodobnie w wodach balastowych statków. Możliwe są cztery drogi jej transportu (Skóra 1996):
1. Z Morza Czarnego przez Dniepr, Prypeć, Pinę, Kanał Królewski, Bug, Wisłę do Zatoki Gdańskiej.
2. Z Morza Azowskiego przez Don, Wołgę, Zbiornik Rybiński, Jeziora Onega i Ładoga, Zatokę Fińską do Zatoki Gdańskiej.
3. Z Morza Kaspijskiego przez Wołgę, Zbiornik Rybiński, Jeziora Onega oraz Ładoga, Zatokę Fińską do Zatoki Gdańskiej.
4. Z Morza Marmara, Morza Czarnego lub Morza Azowskiego przez Morze Jońskie, Morze Śródziemne, Cieśninę Gibraltarska, Kanał La Manche, Cieśniny Duńskie do Zatoki Gdańskiej.
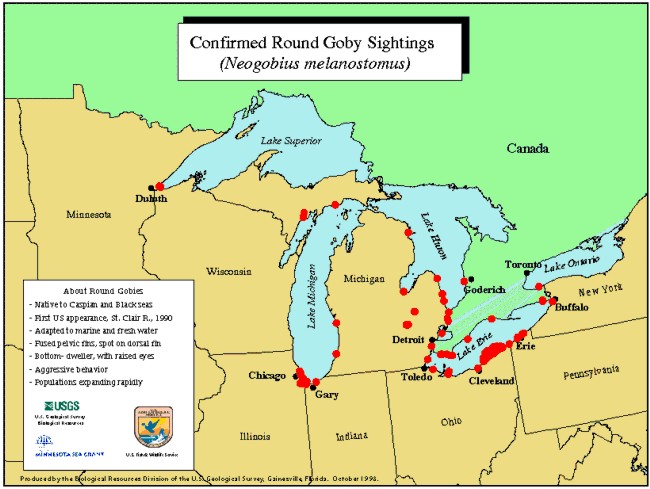
W Ameryce Północnej pierwszy okaz N. melanostomus zanotowano w rzece St. Clair River w 1990 roku (Jude i inni 1992). Obecnie gatunek ten zasiedla następujące rzeki: St. Clair River, Callumet River (Illinois) - niedaleko jeziora Michigan, Detroit River (Ontario), Grand River Harbor (Ochio), Shiawasse River oraz Wielkie Jeziora: Ontario, Erie, Huron, Michigan i Superior (Raloff 1999).
Rys. 5. Lokalizacje obecności
N. melanostomus w Ameryce Północnej
Nie można wykluczyć wtórnego przenoszenia ryb tego gatunku do Europy z Wielkich Jezior Amerykańskich.
W 1995 roku stwierdzono obecność N. melanostomus poza rejonem Zatoki Gdańskiej w Dębkach (Kuczyński za Grygielem 1995). Rok później odnotowano go w Zatoce Pomorskiej. W roku 2000 była już łowiona w Zalewie Wiślanym (Borowski 3001). W tym samym roku odnotowano N. melanostomus w rejonie Rugii w Niemczech oraz w Dunaju w Wiedniu (...). W roku 2002 pierwszy okaz złowiono w Zatoce Parnu w Estonii (Ojaver 2002).
Biologia
N. melanostomus jest rybą demersalną (denną). Występuje w przybrzeżnej strefie mórz na dnie muszlowo-piaszczystym i kamienistym. W Morzu Azowskim zamieszkuje dno do głębokości 20 m (Miller 1986). W Morzu Kaspijskim występuje do głębokości 70 m (Moskalkova 1996). Natomiast w Morzu Czarnym, podczas wiosny i jesieni, ryby gromadzą się w wolno płynących rzekach, lagunach i w przybrzeżnej strefie, na głębokości 20 m. W zimie migrują do głębszych wód, do głębokości 50-60 m (Miller 1986). W Zatoce Puckiej ryby zamieszkują dno mulisto - piaszczyste, porośnięte makrofitami (Skóra 1996). W Zatoce Gdańskiej ryby najczęściej występują w miejscach o dnie pokrytym muszlami oraz w okolicy pirsów, falochronów i innych zabudowań hydrotechnicznych do głębokości 20m (wg.Kuczyńskiego, 1995).
Wiek i wzrost
W pierwotnej strefie występowania N. melanostomus żyje do czterech lat i osiąga długość do 250 mm (Berg 1949; Nikolski 1970). Samce rosną szybciej od samic i osiągają większe rozmiary (Nikolski 1970). Samce osiągają w pierwszym roku życia długość od 100 mm do 130 mm, a w trzecim lub w czwartym roku osiągają 170-180 mm. Samice osiągają w pierwszym roku życia długość od 80 do 110 mm, a maksymalna długość dorosłych samic wynosi 130-140 mm (Berg 1949; Smirnov 1986).
Dzienny przyrost samców jest 1,5 razy większy niż samic. Roczny przyrost zmniejsza się z wiekiem samic, a zwiększa wraz z wiekiem samców (Skazkina i Kostiušenko 1968). W trzecim roku życia samce mogą ważyć trzy razy więcej niż samice. Okres największego wzrostu to sierpień-wrzesień dla samic i lipiec - październik dla samców. Masa ciała samców i samic maleje w miesiącach zimowych (Skazkina i Kostiušenko 1968).
W Morzu Azowskim wzrost jest najszybszy w pierwszym i drugim roku życia. Dominująca klasa długości samców to 100-160 mm, natomiast samic - 80-150 mm. N. melanostomus łowione niewodem w Zalewie Kujbyszewskim miały rozmiary od 22 mm do 135 mm (Tsyplakov 1947).
Śmiertelność naturalna w Morzu Azowskim wynosi 55,1% w drugim roku życia i 89,8% w trzecim roku (Kovtun et al. 1976). Szybszy wzrost jest przeważnie zrównoważony wcześniejszą śmiercią (Kostiušenko 1961).
W Zatoce Gdańskiej spośród zbadanych 211 ryb największy osobnik miał 246 mm długości. Stosunek ilościowy samców do samic wynosił 4:1. Samce były dłuższe niż samice. Masa samców była mniejsza niż masa samic o tej samej długości. Wiek zbadanych ryb wynosił 2-5 lat, z czego 90% ryb było 2-3 letnich. Średnia długość wynosiła 152 mm, 182 mm, 212 mm, odpowiednio dla ryb dwu-, trzy- i czteroletnich (Skóra, Stolarski 1996).
Dymorfizm płciowy
Porównując obie płcie u samców wysokość D1 jest większa, dłuższa podstawa A i długość V, długość i wysokość głowy, długość dolnej szczęki i szerokość głowy, ale mniejsze rozstawienie i średnica oczu niż u samic. U samców również zanotowano większe: wysokości wszystkich nieparzystych płetw, długość P, długość pyska oraz większą odległość od oka do kąta pyska (Bilko i Vybornaja 1972).
U samców, w okresie poprzedzającym tarło, zaczyna zachodzić widoczne zwiększenie wysokości nieparzystych płetw. Brzegi tych płetw stają się postrzępione. Zmieniają się także proporcje określonych części głowy, szczególnie znaczące jest grubienie pokryw skrzelowych. Powoduje to optyczne powiększenie głowy. W miejscu zmiennego ubarwienia pojawia się charakterystyczna szata godowa, której brak u samic. Samce w miarę zbliżania się okresu tarła stają się ciemniejsze, a w okresie tarła są zupełnie czarne, jedynie płetwy są obramowane białą lub kremową obwódką o szerokości ok. 1mm (Bilko 1971; Bilko i Vybornaja 1972).
Rozród
Samice osiągają dojrzałość płciową w drugim, a samce w trzecim roku życia (Nikolski 1970). Tarło odbywa się na głębokości 0,5-3,0 m, czasem do 6 m, bardzo rzadko na głębokości 7-8 m; w miejscach z dostateczną ilością kamieni lub innych twardych przedmiotów. Samce zaczynają budowę gniazda, gdy temperatura wody osiąga 10-12ºC (Smirnov 1986 za Kalinina 1976).
N. melanostomus występuje w rejonach, gdzie zasolenie waha się w zakresie 1-13 PSU. Optymalne zasolenie dla rozrodu w Morzu Azowskim wynosi 9,5-11,0 PSU (Smirnov 1986 za Kostiušenko 1961).
Tarło N. melanostomus zaczyna się przy temperaturze wody 9-10ºC, natomiast masowo przebiega w temperaturze 15-16ºC. Rozród zaczyna się w kwietniu w Morzu Czarnym i Morzu Kaspijskim, trwa do września w Morzu Azowskim. W delcie Wołgi babki rozmnażają się od maja do czerwca w korycie rzeki (Kazančev 1981). W Zatoce Gdańskiej ryby tego gatunku mają dojrzałe gonady od kwietnia do września i rozmnażają się od kwietnia do lipca (Skóra i Stolarski 1996).
W warunkach hodowlanych samica składa jaja w 5-6 porcjach, w odstępach 18-20 dni. Przerwa między porcjami to 28 dni w temperaturze 15-17ºC i 15-17 dni w temperaturze powyżej 20ºC (Kulikova 1985).
Liczba jaj złożonych przez jedną samicę w czasie sezonu rozrodczego waha się od 200 do 9771. Jajo ma wymiary: 3,3-4,0 mm długości i 1,7-1,9 mm szerokości. Czas inkubacji przy temperaturze 16-18ºC wynosi 11-12 doby (Kovtun 1977).
Straty spowodowane wyżeraniem ikry są niewielkie, jeżeli w gnieździe znajduje się 2000-3000 jaj (od jednej lub dwóch samic). Natomiast jeżeli w gnieździe znajduje się 8000- 10000 jaj, to straty mogą wynosić 50-70%.
Stopień zapłodnienia jest wysoki i wynosi 95%. Duży samiec może skutecznie ochronić 95% jaj. Istnieje silna korelacja pomiędzy wzajemnym stosunkiem płci a przeżywalnością narybku. W latach, w których stosunek samców do samic był wysoki (do 1,9) przeżywalność narybku wynosiła 6-14%. W latach gdy ten stosunek był niski (1,1-1,4) przeżywalność wynosiła 70-93%. Przypuszczalnie przewaga samic w populacji prowadzi do większych wylęgów, które nie mogą być odpowiednio chronione przez samce. Stosunek płci może być silnie zakłócany przez połowy przybrzeżne w czasie wiosny, gdy samce wędrują do miejsc tarła, a samice pozostają w głębszych wodach (Kovtun 1979).
N. melanostomus jest rybą, która ochrania potomstwo w specjalnie przygotowanych gniazdach. Instynkt tworzenia gniazda pojawia się niedługo przed okresem rozrodu. Przygotowanie gniazda oznacza fizjologiczną dojrzałość do przystąpienia do tarła. Najważniejszymi czynnikami wpływającymi na aktywność gruczołów dokrewnych są długość dnia i temperatura wody. U samic gotowość do tarła pojawia się nieco później niż u samców (Kovtun 1979).
Samce - w miarę dojrzewania ich produktów płciowych, wraz ze zbliżaniem się sezonu rozrodczego, wędrują w rejony przybrzeżne zajmując odpowiadające im miejsca i wyznaczając terytoria (Kovtun 1979; Moskalkova 1996). Każdy zaczyna ochraniać własne terytorium i budować gniazdo. Pierwszeństwo w zajmowaniu najlepszych miejsc i wyznaczaniu terytoriów mają największe samce, które przeganiają samce mniejsze i słabsze. Na gniazdo samce wybierają twarde elementy dna, z mniej lub bardziej gładką powierzchnią. Gniazda różnych samców oddalone są od siebie o 3 do 10 m. Przy budowie gniazda samiec wynosi piasek, muł i drobne kamienie na odpowiednią odległość. Wnętrze gniazda oczyszcza z resztek mułu i roślinności. Wewnętrzną powierzchnię gniazda samce spajają wydzieliną specjalnych gruczołów. Gruczoły te przed tarłem mają wygląd dużych przezroczystych woreczków, bardziej grubych niż jądra. W rezultacie dno i ściany gniazda są „scementowane” i jest to ważnym czynnikiem zapobiegającym zagrożeniom ikry. W procesie tworzenia gniazda samce przybierają barwę godową i wszystkie ochraniają gniazdo, odstraszając intruzów swoim wyglądem. Niedługo potem na miejsca tarła przybywają samice. Wyszukują one samce, które ukończyły tworzenie gniazda (Ilin 1954).
U N. melanostomus ważną rolę odgrywa sygnalizacja ruchowa i akustyczna, a także wygląd. Wygląd samców ma duże znaczenie w okresie rozrodu, gdyż służy do odstraszania licznych wrogów. Polega to na naprężaniu nieparzystych płetw i rozdymaniu pokryw skrzelowych. Samce odstraszają intruzów wypluwając piach lub muł znajdujący się w pobliżu gniazda, gryząc, a także uderzając głową i ogonem (Smirnov 1986 za Rašeperinem 1967).
Samce wydają dwa rodzaje dźwięków: dźwięki odstraszające przeciwników oraz dźwięki wabiące samice. Dźwięki odstraszające inne ryby przypominają warczenie. Maksymalny czas ich trwania to 1 s. Dźwięki wabiące samice przypominają ciche kwakanie i trwają od 1 do 2,6 s. Samiec używa tych sygnalizacji jednocześnie. Porozumiewanie się ryb ma wizualno-akustyczny charakter (Smirnov 1986 za Rašeperinem 1967).
Po ukończeniu gniazda samiec zaczyna nadawać wabiące dźwięki, przypominające kwakanie. Samice słyszą te dźwięki z odległości 3-7 m i przybliżają się krótkimi skokami. Ustawiają się w pobliżu gniazda w odległości 0,5-1,0 m. Na dźwięki reagują również niedojrzałe samice. Sygnalizacja dźwiękowa jest nieodzownym elementem zachowania godowego. Aktywność dźwiękowa samca wzrasta i jego ciche kwakanie przechodzi w silne skrzeczenie. Dźwięki te pobudzają dojrzałe samice, które odpowiadają dźwiękami przypominającymi piski. Samiec wpuszcza do gniazda największe samice. Pobudza je do składania ikry uderzeniami głowy i ogona. Samica przykleja jaja na suficie gniazda, a samiec natychmiast je zapładnia. Akt ten powtarza się kilkakrotnie, aż do złożenia całej porcji ikry. Po złożeniu ikry samiec staje się agresywny, wydaje warczące dźwięki i wygania samicę z gniazda. Samiec powtarza ten proces z kolejnymi dojrzałymi samicami czekającymi w pobliżu gniazda. Samice, które łożyły jaja odpływają, ale pozostają w niewielkiej odległości od gniazda i intensywnie żerują. Samice po złożeniu wszystkich porcji ikry odpływają w głębsze rejony morza. Następnie samiec opiekuje się ikrą, aż do wyklucia wszystkich młodych. Samiec wachluje płetwami, aby zapewnić stały przepływ natlenionej wody i nie dopuścić do śmierci zarodków. Samce mogą zjadać nie zapłodnione lub zainfekowane pleśnią jaja. Mogą też zjadać całą ikrę w następstwie silnego stresu (Protasov i inni 1965).
W czasie inkubacji ikry samiec staje się najbardziej agresywny; każda ryba w pobliżu gniazda wywołuje u niego reakcję obronną. Samiec przyjmuje groźne pozy, stroszy płetwy, wydyma wieczka skrzelowe i pluje piaskiem w kierunku intruza. W ostateczności może bezpośrednio zaatakować. Intruzów mniejszych rozmiarów (małe skorupiaki, młode ryby) miażdży szczękami. Wydaje również ostrzegawcze dźwięki, słyszalne z odległości 1,0-1,5 m. Po wykluciu się wszystkich młodych samce opuszczają gniazda i wędrują w głębsze rejony morza oddalone od brzegu (Smirnov 1986 za Rašeperinem 1967).
Pokarm
Pożywienie N. melanostomus stanowią głównie drobne zwierzęta bezkręgowe. Najważniejszym składnikiem pokarmowym są mięczaki, a w szczególności małże.
W Zatoce Gdańskiej podstawowym składnikiem pokarmowym N. melanostomus są małże: omułek (Mytilus trossulus), rogowiec bałtycki (Macoma balthica) oraz w niewielkim stopniu sercówka (Cardium glaucum). Równie ważną grupą są skorupiaki: podwoik – (Idotea balthica) i pąkla (Balanus improvisus). Okresowo lub przypadkowo w skład pokarmu N. melanostomus wchodzą również Polychaeta, ikra różnych gatunków ryb oraz inne grupy organizmów (Skóra i Rzeźnik (2000).
W Morzu Czarnym pożywienie N. melanostomus stanowią głównie Mollusca (Cardium, Mytilaster), Crustacea, Pollychaeta, małe ryby oraz ikra różnych gatunków ryb (Berg 1949; Miller 1986). Kovtun (1977) podaje, że 78% pokarmu N. melanostomus stanowią Mollusca, 10% Crustacea, 6% Pollychaeta i 3% ryby.
W rzece St. Clair River pożywienie N. melanostomus stanowią następujące grupy organizmów: Cladocera (Eurycerus), Gammaridae, Ephemeroptera, Ceratopogonidae, Odonata, Diptera, Oligochaeta, Ostracoda, Decapoda, Trichoptera, Bivalvia, Gastropoda (Charlebois 1997 za Ray i Corkum 1997).
Rola w łańcuchu pokarmowym innych gatunków
W pierwotnym rejonie występowania N. melanostomus stanowi ważny składnik pokarmowy wielu gatunków zwierząt. Ikra wyżerana jest przez krewetki: Palemon elegans i Palemon adspersus. Jedna krewetka o długości 5 cm w ciągu doby zjada kilka ziaren ikry, ale uszkadza około 100 sztuk. Isopoda wyjadają do 5 % ikry w gniazdach pilnowanych przez samca i całą ikrę w gniazdach opuszczonych. Ikrą N. melanostomus żywią się również kraby Rhithropanopeus; zjadają one do 42% całkowitej ilości wyżeranej ikry.
W Morzu Kaspijskim i Morzu Azowskim do najważniejszych drapieżników należą: Esox lucis, Huso huso, Acipenser guldenstadti clochicus, Aspius aspius, Lucioperca lucioperca, (Nikolskij 1954; Jablonskaja 1979). Wśród ptaków żerujących na N. melanostomus najważniejsze są czaple: wielka biała, szara i ruda (Ilin 1949). N. melanostomus wchodzi również w skład pokarmu morświna Phocoena phocoena relicta (Smirnov 1986).
W Zatoce Puckiej N. melanostomus (w zależności od pory roku) stanowi od 60 do ponad 90% pokarmu kormorana Phalacrocorax carbo (Bzoma 1998). Ostatnio N. melanostomus zaczął stanowić także pokarm coraz liczniej żerujących tu czapli. Zauważono również, że jedzą go przebywające w strefie przybrzeżnej dorsze (Gadus morhua) i skarpie (Scophtalmus maximus).
Znaczenie gospodarcze
W latach pięćdziesiątych N. melanostomus stanowił od 90 do 95% całkowitej ilości ryb babkowatych poławianych w Morzu Czarnym i Morzu Kaspijskim. Do połowu używano specjalnych włoków i sieci stawnych. W Morzu Azowskim główny czas połowu przypadał na okres, gdy temperatura wody wzrasta do 12-15ºC (Smirnov 1986).
W Morzu Czarnym w latach 1930 – 1940 łowiono 3-4 tys. ton (Skóra 1996 za Svetovidovem 1964). W tym samym okresie w Morzu Azowskim łowiono 2-35 tys. ton. Rekordowy połów przypada na rok 1956, kiedy złowiono 50 tys. ton. Następnie ilość poławianych ryb zaczęła maleć.
Na spadek połowów wpłynęło wiele czynników spowodowanych bezpośrednio lub pośrednio działalnością człowieka. Głównymi przyczynami było: przełowienie, degradacja habitatów, wzrost zanieczyszczenia, eutrofizacja oraz wzrastające zamulanie zbiorników. Połowy spowodowały zaburzenia struktury populacji i spadek efektywności tarła (Kovtun 1976).
W rejonie Zatoki Gdańskiej i Zatoki Puckiej w roku 1996 połowy wynosiły około 50 kg/dzień/łódź. (Skóra 1996). Sytuacja ta trwa nadal. Mimo bardzo obfitych co roku połowów żakowych tej ryby szczególnie wiosną, popyt rynku na ten gatunek nie rozwija się.